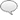Je vous remercie pour votre aide, voici quelques exemples englobant plusieurs type d'énoncés rencontrés, tirés des annales.
Il n'y a pas de souci, j'attendrais demain 
Merci
EX 1 : Soit la réaction : 2 NO2 + O3 => N2O5 + 02
[color=#]Etape 1:[/color] NO2 + O3 => NO3 +O2 constante de vitesse K1
[color=#]Etape 2[/color]: NO2 + NO3 => N2O5 constante de vitesse K2
Quel est l'ordre global de la réaction ?
EX 2: On s'interesse à l'oxydation du monoxyde d'azote par le dibrome. L'équation bilan de la réaction s'écrit :
2NO + BR2 => 2NOBR
On constate que si l'on double la concentration des deux réactifs, la vitesse est multipliée par 8, et si l'on double uniquement la concentration en dibrome, la vitesse est multipliée par 2.
a) On ne peut pas le determiner pour données insuffisantes
b) Ordre 0
c) Ordre 1
d) Ordre 2
e) Ordre 3
EX 3
Un antibiotique A est métabolisé a 37°C avec une constante de vitesse k=1,6,10^-1 h^-1
L'efficacité d'un traitement par cet antibiotique implique de maintenir une concentration toujours superieur à 1,2 mg de produit par kg de masse corporelle.
Une patiente dont la masse est égale à 50kg absorbe à intervalles réguliers des comprimés renfermant 300 mg de cet antibiotique.
A quel type de cinétique le métabolisme obéit-il vi a vis de cet antibiotique ?
A) Ordre -2
B) ordre -1
C) ordre 0
D) ordre 1
E) on ne peut pas déterminer l'ordre car données insuffisantes
EX 4 : Soit une réaction impliquant un réactif A. Voici le suivie de la concentration de A en fonction du temps
t(min)________________ 0 10 20 40
Concentration (molL-1) ___ 10 8 6 2
Quel est l'ordre cinétique global de réaction?
voila :/
je vous remercie pour votre patience
|
 Auteur
Auteur
 Chimie
Chimie